
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Das Virus-Transport-Kit von BABIO erhält die 510(k)-Zulassung der FDA
2025-10-30
Das Virus-Transport-Kit von BABIO erhält die 510(k)-Zulassung der FDA
Jinan, China – Oktober 2025– BABIO Biotechnology, ein renommierter chinesischer Hersteller medizinischer Diagnosereagenzien, gibt stolz bekannt, dass esVirus-Transport-Kit (nicht inaktivierend)erhalten hatFDA 510(k)-Zulassung (K250205)und bestätigt damit offiziell die Einhaltung der US-amerikanischen Regulierungsstandards.
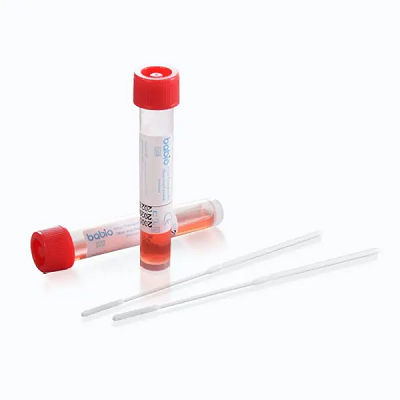
Dieser Meilenstein stärkt BABIOs weltweite Führungsposition bei Transportlösungen für klinische Proben. Das Kit wurde für die sichere und stabile Sammlung viraler Proben entwickelt und unterstützt nachgelagerte Anwendungen wie zRT-PCR, Viruskultur, UndMolekulare Diagnostik. Es verfügt über:
-
✅ Raumtemperaturstabilität
-
✅ Verbesserte Hank-Lösung mit Antibiotika
-
✅ DNase/RNase-freie konische Röhrchen
-
✅ Sichere Beflockungstupfer mit Haltepunktdesign
Das Kit ist in mehreren Füllvolumina (1–6 ml) und Packungsgrößen (20–500 Röhrchen) erhältlich und eignet sich ideal für Krankenhäuser, Labore und öffentliche Gesundheitseinrichtungen weltweit.
Mit einemtägliche Produktionskapazität von 100.000 EinheitenBABIO sorgt für eine konsistente Versorgung und wettbewerbsfähige Preise. Vertrauen in dieVereinigte Staaten, DeutschlandUnd darüber hinaus liefert BABIO weiterhin Innovation und Zuverlässigkeit bei Virentransportsystemen. Erfahren Sie mehr unter https://www.babiocorp.com.
#VirusTransportKit #FDA510k #BABIO #ClinicalDiagnostics #VTM #RT-PCR #GlobalHealthcare #MedicalDevices #SpecimenCollection


